 |
Turku, Finland and Laupheim, Germany, January 17, 2011 / b3c newswire / - Faron Pharmaceuticals Ltd. and Rentschler Biotechnologie GmbH announced today that they have signed a manufacturing and supply agreement for the Faron product FP-1201 that is also known as Traumakine®. The active pharmaceutical ingredient of the FP-1201 is recombinant human interferon beta-1a (IFN-beta 1a) that was first produced by Rentschler already in the late 1980’s. According to the agreement Rentschler will become the sole global manufacturer of IFN-beta 1a for Faron and also manufacture Faron’s proprietary bulk drug product. Traumakine® is formulated so that it is stable at room temperature and readily available for critical care doctors at intensive treatment units. Traumakine® is meant to prevent vascular leakage in patients with acute lung injuries (ALI) and its more severe form ARDS. This prevention is critical to sustain respiratory function in ALI/ARDS patients. Financial details of the agreement were not disclosed.
"Our aim is to build a specialty pharma product for critical care doctors treating ALI/ARDS patients at intensive care units", comments Faron’s CEO Markku Jalkanen. "We are very satisfied with our collaboration with Rentschler and their experience with manufacturing and formulation of interferon-beta. This agreement allows Faron to move to final clinical development stage of Traumakine®, and to file marketing authorization application to European Medicines Agency (EMA) following the conduction of the pan-European pivotal trial in years 2012-14", continues Jalkanen.
"Rentschler has the longest history of IFN-beta manufacturing and formulation development in the world, and is therefore the best partner for Faron’s Traumakine® project", comments Klaus Schoepe, Senior Vice President Client Relations of Rentschler. "We bring to this product our process of IFN-beta manufacturing together with our capacity to finalize the Faron product and are very motivated to aid Faron in bringing Traumakine® to global markets in this new indication ALI/ARDS", continues Schoepe.
About ALI/ARDS and Traumakine®-program
Acute Lung Injury (ALI) and a related condition Acute Respiratory Distress Syndrome (ARDS) are serious clinical disorders, which follow a variety of severe direct and indirect lung insults. In serious life threatening situations such as infection leading to sepsis or trauma causing massive tissue injuries, an escalation of the systemic inflammatory response leads to multiple organ failure including ALI/ARDS. In the case of ALI/ARDS the predominant patho-physiological result is increased vascular leakage, which has been shown to be due to the lack of adenosine, an end product of AMP degradation by 5’-nucleotidase. Adenosine acts to enhance endothelial barrier function via adenosine receptor activation. Therefore, any biological substance, which acts to increase adenosine level, will reduce vascular leakage and be of benefit in ALI/ARDS. Such substances are type I interferons, and especially the interferon-beta (IFN-beta). IFN-beta has been shown to up-regulate 5’-nucleotidase (also known as a CD73 molecule and expressed abundantly by endothelial cells) and prevent ALI in animal models (Kiss et al. (2007) Eur. J. Immunol. 37:3334). IFN-beta is therefore a potential treatment for ALI/ARDS. The schematic drawing below (Figure 1) illustrates this principle.
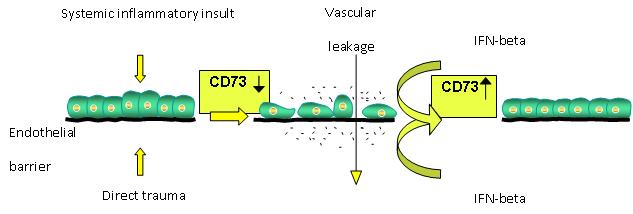
Figure 1: A model of IFN-beta action in acute injuries and prevention of vascular leakage
Faron has been granted an orphan drug status for interferon beta (FP-1201) in ALI/ARDS by European Commission and European Medicines Agency (EMA) under the registration number EU/3/07/505. Faron has also been granted several patents both in USA and Europe for this new use of IFN’s to treat various ischemic conditions.
About Faron Pharmaceuticals - www.faronpharmaceuticals.com
Faron Pharmaceutical Ltd. is a privately owned clinical stage drug discovery and development company in Turku, Finland. Today Faron has three major drug development projects focusing on acute trauma, incipient vasculopathies, inflammatory diseases, and cancer/metastasis growth.
Faron’s lead product Traumakine® is currently being assessed in a phase I/II study in the UK to treat vascular leakage in ALI/ARDS patients. For more information, visit www.faronpharmaceuticals.com.
About Rentschler Biotechnologie – www.rentschler.de
Rentschler Biotechnologie GmbH is a global full-service contract manufacturer with more than 30 years of experience in the development, production and approval of biopharmaceuticals in compliance with international GMP standards (EMA/FDA). Rentschler Biotechnologie has nine GMP suites with volumes of 30, 50, 250, 500, 1,000 and 2,500 liters, allowing the production of material for clinical trials (phase I to III) and for market supply. Rentschler also provides regulatory advice, protein analytics, quality control, and the sterile filling of syringes and injection vials. The company is family-owned and independent and has currently about 600 employees.
Further information:
Prof. Markku Jalkanen, CEO
Phone: +358-40-520-6124
E-mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
Dr. Klaus B. Schoepe
Phone: +49 7392 701-810
E-mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
Rentschler übernimmt Herstellung von Farons Traumakine®
Turku, Finnland, und Laupheim, Deutschland – 17. Januar 2011 / - Faron Pharmaceuticals Ltd. und Rentschler Biotechnologie GmbH gaben heute bekannt, einen Herstellungs- und Liefervertrag für das Faron-Produkt FP-1201, auch bekannt als Traumakine®, unterzeichnet zu haben. Der arzneilich wirksame Bestandteil von FP-1201 ist das rekombinante humane Interferon-beta-1a (IFN-beta-1a), das Rentschler als erster Hersteller bereits Ende der achtziger Jahre hergestellt hatte. Gemäß den Vertragsbedingungen wird Rentschler damit der exklusive Hersteller von IFN-beta-1a für Faron; außerdem soll Rentschler in Zukunft das proprietäre Arzneimittel für Faron herstellen. Die Formulierung von Traumakine® ist bei Raumtemperatur stabil, so dass es für Ärzte auf Intensivstationen sofort verfügbar ist. Traumakine® soll zur Prävention von Gefäßundichtigkeit bei Patienten mit akuter Lungenverletzung (Acute Lung Injury/ ALI) und ihrer schwereren Form, dem Lungenversagen (Acute Respiratory Distress Syndrome / ARDS) angewendet werden, um die respiratorische Funktion bei diesen Patienten zu erhalten. Die finanziellen Einzelheiten der Vereinbarung wurden nicht bekannt gegeben.
„Unser Ziel ist es, ein Spezialpräparat für Intensivmediziner zu entwickeln, damit Patienten mit ALI/ARDS auf Intensivstationen effektiv behandelt werden können“, erklärt Markku Jalkanen, CEO von Faron. „Wir sind mit unserer Zusammenarbeit mit Rentschler und deren Erfahrung bei der Herstellung und Formulierung von Interferon-beta äußerst zufrieden. Dank dieser Vereinbarung kann Faron nun in die letzte klinische Entwicklungsphase von Traumakine® eintreten undbei der Europäischen Arzneimittelagentur (EMA) nach Abschluss der entsprechenden klinischen Studie, die in den Jahren 2012 – 2014 in mehreren europäischen Ländern durchgeführt wird, einen Antrag auf Marktzulassung einreichen“, so Jalkanen weiter.
„Rentschler kann weltweit auf die längste Geschichte im Bereich Herstellung und Formulierung von IFN-beta zurückblicken und ist daher für das Traumakine®-Projekt von Faron ein idealer Partner“, betont Klaus Schoepe, Bereichsleiter Kundenmanagement bei Rentschler. „Wir bringen in dieses Projekt unser IFN-beta-Herstellungsverfahren sowie unsere Fähigkeit zur Finalisierung des Produktes mit ein. Wir sind sehr motiviert, Faron dabei zu unterstützen, Traumakine® für die neue Indikation ALI/ARDS auf den weltweiten Markt zu bringen“, führte Schoepe weiter aus.
Über ALI/ARDS und das Traumakineâ-Programm
Die akute Lungenverletzung (ALI) und der damit verwandte Zustand des akuten Lungenversagens (ARDS) sind schwere klinische Störungen, die nach einer Reihe akuter direkter oder indirekter Lungeninsulte auftreten. In ernsthaft lebensbedrohlichen Situationen, wie z. B. einer Infektion mit anschließender Sepsis oder Trauma, die massive Gewebsverletzung verursachen, führt eine Eskalation der systemischen inflammatorischen Reaktion zu multiplem Organversagen wie z. B. ALI/ARDS. Die vorherrschende pathophysiologische Folge von ALI/ARDS ist eine verstärkte Gefäßundichtigkeit, die durch das Fehlen von Adenosin, einem Endprodukt des AMP-Abbaus durch 5’-Nukleotidase verursacht wird. Die Wirkweise von Adenosin besteht in der Verbesserung der endothelialen Schrankenfunktion mittels Aktivierung des Adenosinrezeptors. Daher vermindert jede biologische Substanz, welche die Adenosinkonzentration erhöht, die Gefäßundichtigkeit und stellt für Patienten mit ALI/ARDS einen klinischen Nutzen dar. Bei solchen Substanzen handelt es sich um Typ-I-Interferone, insbesondere um Interferon-beta (IFN-beta). IFN-beta reguliert nachweislich die 5’-Nukleotidase (auch als CD73-Molekül bekannt und normalerweise von den Endothelialzellen im Überfluss exprimiert) hoch und verhindert ALI im Tiermodell (Kiss et al. (2007) Eur. J. Immunol. 37:3334). IFN-beta stellt daher eine potenzielle Behandlungsmöglichkeit für ALI/ARDS dar. Die nachfolgende Schemazeichnung (Abbildung 1) verdeutlicht dieses Prinzip.
Abbildung 1: Ein Modell der Wirkweise von IFN-beta bei akuten Verletzungen und der Vermeidung von Gefäßundichtigkeit
Unter der Zulassungnummer EU/3/07/505 erteilten die Europäische Kommission und die Europäische Arzneimittelmittelagentur (EMA) Faron den Orphan-Drug-Status für Interferon-beta (FP-1201) bei ALI/ARDS. Faron besitzt außerdem mehrere Patente in den USA und Europa für diese neue Anwendung von Interferonen zur Behandlung von verschiedenen ischämischen Zuständen.
Über Faron Pharmaceuticals, Ltd.: Faron ist ein Unternehmen im Privatbesitz, welches auf dem Gebiet der Erforschung und klinischen Entwicklung von Arzneimitteln tätig ist. Gegenwärtig bearbeitet Faron drei wichtige Projekte zur Arzneimittelentwicklung mit den Schwerpunkten akute Traumen, beginnende Vaskulopathien, Entzündungskrankheiten, Karzinomwachstum und Metastase spezialisiert. Farons Leitprodukt Traumakine® wird zurzeit in Großbritannien in einer Phase-I/II-Studie zur Behandlung von Gefäßundichtigkeit bei Patienten mit ALI/ARDS geprüft. Weitere Informationen sind unter www.faronpharmaceuticals.com verfügbar.
Über Rentschler Biotechnologie- www.rentschler.de
Die Rentschler Biotechnologie GmbH ist ein weltweit agierendes Full-Service Auftragsunternehmen mit mehr als 30 Jahren Erfahrung in Entwicklung, Produktion und Zulassung von biopharmazeutischen Wirkstoffen und erfüllt die internationalen Standards der guten Herstellungspraxis (GMP, Good Manufacturing Practice). Rentschler Biotechnologie verfügt über neun unabhängige GMP-Suiten mit Volumen von 30, 50, 250, 500, 1000 und 2500 Litern zur Herstellung von Material für klinische Studien (Phase I bis III) und für die Marktversorgung. Rentschler bietet außerdem regulatorische Beratung, Proteinanalytik, Qualitätskontrolle und die sterile Abfüllung von Spritzen und Injektionsflaschen an. Das inhabergeführte, unabhängige Unternehmen beschäftigt derzeit rund 600 Mitarbeiter.
Kontakt:
Prof. Markku Jalkanen, CEO
Telefon: +358-40-520-6124
E-Mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
www.faronpharmaceuticals.com
Dr. Klaus B. Schoepe
Telefon: +49 7392 70-810
E-Mail: This email address is being protected from spambots. You need JavaScript enabled to view it.


